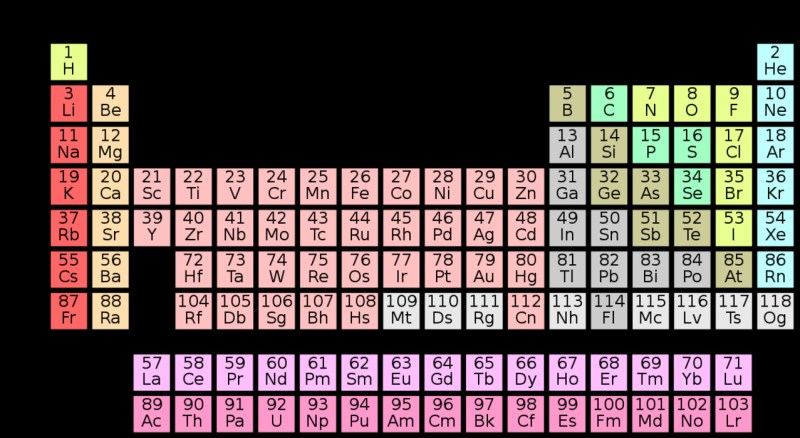
Sistem Periodik Unsur Unsur Kimia Yang Jelas – Periode dalam tabel periodik adalah baris horizontal dalam tabel periodik. Dalam tabel periodik, unsur-unsur disusun dalam satu baris (atau periode) sehingga unsur-unsur yang mempunyai sifat serupa muncul dalam kolom yang sama. Unsur-unsur pada periode yang sama memiliki jumlah kulit elektron yang sama; Saat setiap golongan berpindah dalam tabel periodik, unsur tersebut memiliki lebih banyak proton dan elektron, dan sifat logamnya menurun. Susunan ini menunjukkan pengulangan periodik struktur serupa seiring bertambahnya nomor atom. Misalnya, logam alkali termasuk dalam satu golongan (golongan 1) dan memiliki sifat serupa, seperti reaktivitas tinggi dan kecenderungan kehilangan elektron serupa dengan konfigurasi elektron gas mulia. Ada total 118 unsur dalam tabel periodik.
Hukum urutan energi Madelung menggambarkan urutan orbital yang disusun berdasarkan kenaikan energi menurut hukum Madelung. Setiap diagonal mengandung nilai n + l yang berbeda.
Sistem Periodik Unsur Unsur Kimia Yang Jelas

Mekanika kuantum modern menggambarkan perilaku periodik dalam bentuk kulit elektron. Dengan bertambahnya nomor atom, kulit elektron terisi elektron dengan urutan seperti ditunjukkan di sebelah kanan. Isi setiap cangkang sesuai urutan tabel.
Sistem Tabel Periodik
Pada blok s dan blok p pada tabel periodik, unsur-unsur pada periode yang sama biasanya tidak menunjukkan tren dan keseimbangan unsur (yang merupakan cara yang lebih jelas untuk mengurutkan satu golongan). Namun pada blok d tren pada semua periode menjadi signifikan, dan pada entri blok f menunjukkan tingkat keseragaman yang tinggi pada semua periode.
Tujuh musim unsur terjadi secara alami di bumi. Lihat tabel periodik terperinci untuk musim 8, yang mencakup fitur-fitur yang mungkin dibuat setelah tahun 2015.
Golongan dalam kimia mengacu pada keluarga zat serupa yang termasuk dalam keluarga berbeda. Ada 7 periode yang tersusun mendatar dalam tabel periodik.
Periode 1 merupakan periode terkecil dan terpadat dengan hanya 2 unsur yaitu hidrogen dan helium. Oleh karena itu, mereka tidak mematuhi aturan oktet. Secara kimiawi, helium berperilaku seperti gas mulia, sehingga tergolong dalam unsur golongan 18 atau di antara atau terbagi menjadi unsur-unsur. secara bersamaan memasuki dua grup sekaligus dengan grup 2 dan 18. Hidrogen dengan mudah kehilangan dan memperoleh elektron, sehingga dari sudut pandang kimia ia terbagi menjadi dua golongan sekaligus, yaitu. elemen dalam kelompok 1 dan 17.
Susunan Berkala Unsur Unsur Kimia: Tabel Sistem Periodik Modern
Musim 2 terdiri dari 8 episode. Unsur periode 2 mengandung orbital 2 dan 2p. Pada periode ini, beberapa unsur selain hidrogen, yang disebut karbon, nitrogen, dan oksigen, merupakan unsur dasar biologi.
Musim 3 terdiri dari 8 episode. Ketiga unsur periodik terdapat di alam dan memiliki satu isotop stabil. Kecuali gas mulia argon, semua unsur penting dalam biologi dan geologi.
Dari kiri ke kanan, larutan encer: Co(NO3)2 (merah); K2Cr2O7 (oranye); K2CrO4 (kuning); NiCl2 (hijau); CuSO 4 (biru); KMnO4 (ungu).

Periode 4 mengandung 18 unsur, dimulai dengan kalium (K) dan diakhiri dengan kripton (Kr). Periode 4 mengandung unsur biologis penting yaitu kalium dan kalsium, dan merupakan periode pertama pada blok d dengan logam pengubah cahaya. Ini termasuk besi, unsur terberat yang ditemukan di bintang deret utama dan inti Bumi, serta logam penting lainnya seperti kobalt, nikel, tembaga, dan seng. Hampir semuanya memiliki peran biologis.
Gambar Tabel Periodik & Tabel Gratis
Periode 5 mengandung 18 unsur, dimulai dengan rubium (Rb) dan diakhiri dengan xenon (Xe). Unsur dengan peran biologis terbesar pada manusia adalah molibdenum dan yodium. Periode ini juga mencakup teknesium, bahan radioaktif yang sangat ringan.
Periode 6 mengandung 32 unsur, dimulai dengan sesium (Cs) dan diakhiri dengan radon (Rn). Periode 6 merupakan periode pertama yang memiliki blok f pada golongan lantana (juga dikenal sebagai tanah jarang), dan periode ini mengandung unsur stabil terberat (timbal). Sebagian besar logam ini merupakan logam beracun dan 5 di antaranya bersifat radioaktif (prometium, bismut, polonium, astatin, dan radon), namun platina dan emas hampir seluruhnya tidak aktif. Tungsten merupakan unsur dengan peran biologis yang sangat penting.
Periode 7 mengandung 32 unsur yang dimulai dengan fransium (Fr) dan diakhiri dengan oganeson (Og). Semua bagian musim ke-7 bersifat radioaktif. Saat ini, unsur alami terberat di bumi adalah plutonium. Saat ini, semua elemen masa depan digabungkan secara artifisial. Meskipun salah satunya (einsteinium) saat ini tersedia dalam jumlah makroskopis, namun sangat jarang dan hanya dapat disintesis dalam jumlah mikrogram atau kurang. Beberapa di antaranya tidak teridentifikasi di laboratorium dengan beberapa atom pada waktu yang bersamaan.
Meskipun kurangnya faktor-faktor ini menunjukkan bahwa hasil tes tidak meyakinkan, tren dan kelompok perilaku periode tertentu pada periode ke-7 kurang terdefinisi dengan baik dibandingkan periode lainnya. Meskipun fransium dan radium menunjukkan karakteristik serupa pada golongan 1 dan 2, aktin menunjukkan perbedaan perilaku dan laju oksidasi yang lebih besar dibandingkan lantanum. Periode 7 yang membingungkan ini mungkin disebabkan oleh berbagai faktor, termasuk banyaknya kopling spin-orbit dan efek terkait. Asumsi terakhirnya adalah bahwa hal ini disebabkan oleh tingginya muatan positif inti atom mereka yang besar.
Gambar Tabel Periodik Modern Hd
Periode 8 kemungkinan mengandung 50 atau 54 unsur, dimulai dengan uninunium (Uue) dan diakhiri dengan unhexoctium (Uho) (Z = 168) atau unseptbium (Usb) (Z = 172). Tidak ada elemen yang berhasil dieksekusi pada siklus 8. Blok G merupakan prediksi. Belum jelas apakah semua elemen yang diperkirakan pada periode ke-8 secara fisik mungkin ada.
1·2·3·4·5·6·7·8·9·10·11·12·13·14·15·16·17·18 Tabel periodik mencantumkan masing-masing bahan kimia dalam setiap sistem. Ada banyak sekali unsur kimia yang mempunyai sifat berbeda antara satu unsur dengan unsur lainnya.
Mengutip kelas
Dalam penyusunan tabel periodik, sifat fisika dan kimia setiap unsur telah dijelaskan oleh ahli kimia dalam bentuk tabel unsur.
Gambar Sistem Periodik
Fungsi tabel periodik unsur adalah membantu menentukan nomor atom, konfigurasi elektron, dan mempelajari sifat-sifat setiap unsur beserta baris-barisnya.
Pada tabel periodik, Anda akan melihat golongan dan periode pada kolom. Golongan adalah kolom vertikal atau baris vertikal dalam tabel periodik. Sedangkan waktu merupakan kolom atau garis mendatar.
Pengelompokan unsur-unsur berdasarkan struktur serupa telah berkembang dari yang paling sederhana hingga yang paling maju. Dimulai oleh Antoine Lavoisier hingga dilakukan oleh Henry Moseley, seorang ahli kimia asal Inggris yang menemukan cara menentukan nomor atom.
Dalam buku “Kimia” karya Nana Sutresna dijelaskan bahwa pada tahun 1913 Moseley melakukan eksperimen yang mengukur panjang benda dengan sinar-X.
Cara Mudah Menghafal Tabel Periodik Golongan A Halaman 1
Eksperimen Moseley menghasilkan kesimpulan bahwa struktur unsur tidak didasarkan pada proporsi atom relatif, tetapi berdasarkan peningkatan jumlah proton, yaitu adanya unsur-unsur dengan massa atom berbeda tetapi dengan jumlah proton yang sama. yang . itu disebut isotop.
Ikatan jumlah proton ini menunjukkan peningkatan nomor atom suatu unsur. Oleh karena itu, sifat-sifat unsur merupakan fungsi dari periode nomor atom tertentu.
Tabel periodik modern berisi 7 periode. Musim dibedakan menjadi 2 jenis yaitu musim panjang (4, 5, 6 dan 7) dan musim pendek (1, 2 dan 3).

Jumlah golongan pada tabel periodik terdiri dari 8 golongan utama (golongan A) dan 8 golongan tambahan (golongan B). Unsur golongan B disebut unsur transisi. Zat golongan B ditempatkan di antara golongan IIA dan IIA.
Solution: Tugas Kimia Perkembangan Sistem Periodik
Dalam tabel periodik, Anda akan menemukan bilangan urutan sifat-sifat unsur berdasarkan nomor atom, keelektronegatifan, energi ionisasi, logam dan nonlogam, serta afinitas elektron.
Jari-jari atom adalah jarak dari inti atom sampai kulit terluar suatu atom. Seiring waktu jari-jari atom akan bertambah dari atas ke bawah golongan. Hal ini disebabkan bertambahnya jumlah atom dan kulit elektron dalam satu golongan.
Seiring berjalannya waktu, jari-jari atom mengecil dari kiri ke kanan, sehingga muatan inti efektif berkurang. Semakin besar jumlah proton dalam muatan inti efektif, semakin menarik inti terhadap elektron terluar.
Ionisasi adalah pelepasan energi dari elektron yang terikat lemah pada suatu atom atau ion dalam keadaan gas. Secara periodik dalam satu golongan, dari atas ke bawah, energi ionisasinya berkurang selama periode tertentu, dari kiri ke kanan energi ionisasinya bertambah.
Apa Pengertian Unsur Dan Contohnya Dalam Kehidupan Sehari Hari
Secara berkala, dari golongan atas ke bawah, afinitas elektron menurun (menjadi lebih kecil) dari kiri ke kanan melalui Golongan VII A dan cenderung meningkat (lebih besar) kecuali pada unsur alkali tanah dan gas mulia.
Semua unsur golongan utama mempunyai ikatan elektron negatif, dengan unsur golongan terbesar adalah halogen. Semakin rendah nilai afinitas elektron maka semakin besar kecenderungan atom atau ion tersebut untuk menerima elektron (semakin besar afinitas elektronnya).
Keelektronegatifan atau keelektronegatifan adalah kecenderungan suatu atom untuk menarik pasangan elektron sehingga membentuk ikatan. Zat dengan potensi ionisasi dan afinitas elektron yang lebih besar akan memiliki keelektronegatifan yang lebih besar.

Pada interval tertentu dalam suatu golongan, dari atas ke bawah, keelektronegatifan berkurang, tetapi dari kiri ke kanan selama periode tersebut meningkat, sehingga memudahkan pelepasan atom. Nilai keelektronegatifan diukur menggunakan skala Pauling, antara 0,7 (Fr) – 4,0 (Fr).
Tabel Periodik Unsur Kimia Dan Keterangannya Lengkap Dengan Gambar Hd Yang Bisa Kamu Download Alihamdan
Sifat logam dan nonlogam adalah kecenderungan atom kehilangan elektron dan membentuk ion bermuatan positif (tergantung energi ionisasi).
Sifat logam berhubungan dengan elektropositif. Semakin tinggi energi ionisasi maka semakin rendah sifat logamnya karena sulit melepaskan elektronnya. Sedangkan sifat nonlogam berkaitan dengan keelektronegatifan, yaitu kecenderungan atom menarik elektron.
Unsur nonlogam yang paling reaktif berada pada golongan VIIA (lihat Sifat Logam dan Nonlogam), dan golongan VIIIA (gas mulia) tidak aktif.
Kadang-kadang
Jual Unsur Terlengkap & Harga Terbaru Maret 2024
Sistem periodik unsur kimia lengkap, unsur periodik kimia lengkap, gambar sistem periodik unsur kimia, tabel periodik unsur kimia yang jelas, sistem periodik unsur unsur kimia yang jelas, tabel periodik unsur yang jelas, gambar periodik unsur kimia, daftar periodik unsur kimia, sistem periodik unsur kimia pdf, perkembangan sistem periodik unsur kimia, tabel sistem periodik unsur kimia, sistem periodik unsur kimia