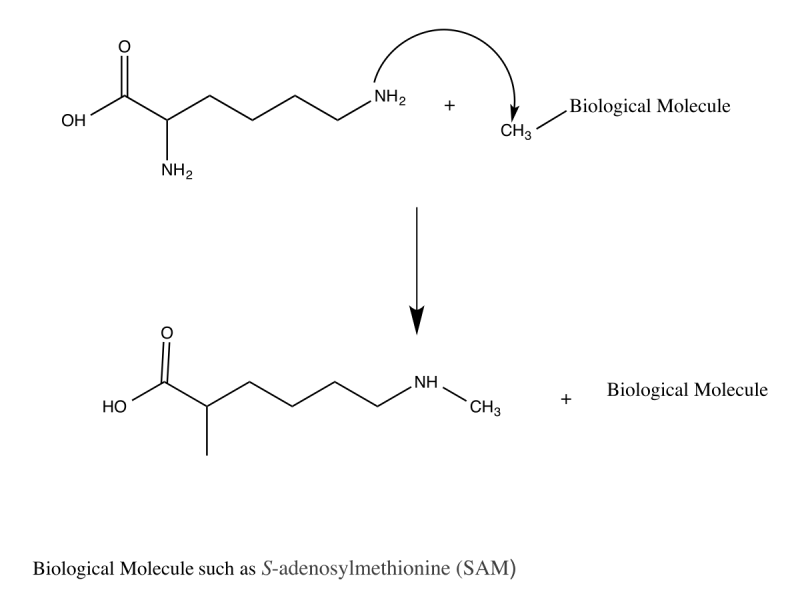
Apa Itu Adisi Dalam Kimia – Jawaban: Polimer adisi memutus ikatan rangkap, sedangkan polimer kondensasi menggabungkan dua monomer berbeda dengan produk sampingan seperti air dan amonia. Perbedaan detailnya dapat dilihat pada gambar. Polimer adalah senyawa besar yang menggabungkan beberapa molekul kecil menjadi molekul raksasa dengan berat molekul tinggi. Berdasarkan proses pembentukannya, merupakan polimer adisi dan polimer kondensasi. Polimer adisi adalah polimer yang dibentuk oleh reaksi monomer (unit molekul kecil yang membentuk agregat) satu sama lain, menggunakan proses pemisahan ganda. Reaksi ini sering disebut reaksi adisi. Polietilen dan polivinil klorida (PVC) adalah contoh polimer yang dihasilkan dari reaksi monomer satu sama lain menggunakan proses pemisahan molekul. Misalnya pelepasan protein dari asam amino, pelepasan selulosa dari glukosa. Dari sini dapat disimpulkan bahwa polimer adisi melibatkan pemutusan ikatan rangkap, sedangkan polimer kondensasi melibatkan penggabungan dua monomer berbeda dengan produk sampingan seperti air dan amonia.
Koloid diproduksi dengan metode sebagai berikut: 1. Reaksi redoks 2. Hidrolisis 3. Peptisasi 4. Metode difusi adalah sebagai berikut: a. 1 dan 2 gram. 1 dan 3 hal. 2. dan 3.d. 2. dan 4.c. 3 dan 4 280 0,0 Jawaban tercentang
Apa Itu Adisi Dalam Kimia

Tentukan I., II. atau AKU AKU AKU. sistem (semua molekul CH2Cl2) memiliki daya tarik antarmolekul terkuat dan membenarkan pilihannya. 150 0.0 Tanggapan Terverifikasi Apakah Anda menyukai buku ini? Publikasikan buku Anda online gratis dalam hitungan menit! Buat flipbook Anda sendiri
Contoh Alkana, Alkena, Alkuna Beserta Pengertian Dan Rumusnya
Kimia Organik I 101 Zat antara karbokation adalah elektrofil, sehingga bereaksi dengan nukleofil dengan menerima pasangan elektron bebas dari nukleofil. Di sini, peran nukleofil adalah Br-. Karbokation bereaksi dengan brom, menghasilkan ikatan C-Br dan produk akhir dari reaksi adisi. Elektron pi H 3C H H Br H 3C C CH membentuk ikatan C-H dengan Br H-Br dan ikatan C-Br yang bermuatan positif dan C C CH3 CH3 Netralisasi muatan positif Br H pada atom karbon H 3C H 3C. 4.22. angka. Reaksi adisi HBr menjadi 2-metilpropena
H Br H3CC CH3 laju reaksi Br 4.23. angka. Diagram energi reaksi adisi elektrofilik HBr dalam 2-metilpropena dapat digunakan tidak hanya untuk HBr, tetapi juga untuk HCl dan HI.
H Cl eter 2-kloro-2-metil-3-propana CH Cl H3C H2 H3C 1-kloro-2-metilpropana 2-metilpropana Tidak terbentuk 4.25. angka. Penambahan HBr pada 2-Metilpropena Pada tahun 1969, ahli kimia Rusia Vladimir Markovnikov mengusulkan aturan yang disebut Hukum Markovnikov, yang menyatakan:
H CH3 Br eter H H H 1-metilsikloheksana 1-bromo-1-metilsikloheksana berikatan dengan 4,26. gugus alkil pada Gambar. Sebagai contoh penerapan hukum Markovnikov, produk campuran terbentuk ketika atom karbon berikatan rangkap suatu alkena mempunyai derajat substitusi yang sama.
Diantara Pernyatan Berikut Yang Termasuk Kedalam P
H Cl H3C H3C H3C 2-Metilpropena CH CH2 CH Cl H2 H3C H3C Karbokation 10 Tidak terbentuk 1-kloro-2-metilpropana 4.28. angka. Alkena dapat ditambahkan dengan mekanisme yang mirip dengan asam halida (HX) untuk menghasilkan produk yang lebih stabil. Secara umum, reaksi Markovnikov menghasilkan produk sampingan. Misalnya penambahan HBr
Dominan. Pada contoh di atas, produk adisi radikal bebas adalah 1-bromopropana, bukan 2-bromopropana. Karena penguraian hidrogen klorida yang relatif lambat, tidak ada radikal bebas yang ditambahkan ke alkena.
Dan menghasilkan satu karbokation dengan tiga substituen metil (karbokation tersier, 30) dan satu karbokation dengan satu substituen alkil (karbokation primer, 10). Karbokation bereaksi dengan nukleofil seperti klor membentuk alkil klorida. Dari hasil penelitian yang diperoleh hanya 2-kloro-2-metilpropana, karena pembentukan zat antara karbokation tersier lebih stabil dibandingkan dengan karbokation primer. Perhatikan bahwa karbokation yang lebih tersubstitusi lebih stabil

Pasal 108 Leli Prasojo, S. Pharm., Op. Urutan kestabilan karbokation adalah sebagai berikut : H H R R HC RC RC RC RC H H H R HC RC RC RC H H H R Metil Primer (10) Sekunder (20) Tersier (30) Kurang stabil Lebih stabil Lebih stabil 4.31. angka. Urutan kestabilan karbokation Mengapa karbokation tersubstitusi lebih stabil? Ada dua alasan utama untuk menjawab pertanyaan ini, yaitu efek induksi substitusi dan hiperkonjugasi. Akibat efek induksi, elektron-elektron pada ikatan sigma berpindah karena perbedaan energi listrik atom-atom tetangganya. Gugus alkil merupakan gugus donor elektron sehingga menstabilkan muatan positif karbokation, sedangkan atom hidrogen tidak dapat menyumbangkan elektron. Jadi, semakin banyak gugus alkil yang ditambahkan pada suatu karbokation, semakin stabil karbokation tersebut. RR R H C C C C RH HH RR HH 30: Ada tiga alkil 20: Ada dua alkil 10: Ada satu alkil penyumbang metil: Tidak ada alkil penyumbang elektron 4.32. angka. Efek induktif gugus alkil
Pdf) Pengaruh Ph Pada Sintesis 4 [n (4 Hidroksifenil) Karboksimidoil] 2 Metoksifenol Melalui Reaksi Adisi Eliminasi
KIMIA ORGANIK I 109 Hiperkonjugasi akibat stabilitas alkena tersubstitusi merupakan konsekuensi interaksi antara orbital p kosong dan orbital ikatan sigmoid C-H yang berdekatan. Semakin banyak gugus alkil yang ditambahkan pada karbokation, semakin besar potensi hiperkonjugasi sehingga karbokation menjadi stabil. Misalnya, hiperkonjugasi terjadi pada etil karbokation. Interaksi antara orbital ikatan sigma dan orbital p yang kosong menstabilkan karbokation dan menurunkan energinya. 4.33. Dapat dilihat pada gambar bahwa dua ikatan C-H sejajar sehingga dapat mengalami hiperkonjugasi. H H C CH H H 4.33. angka. Orbital Molekul pada Etil Karbokation 10. Postulat Hammond merupakan bahan penting untuk memahami reaksi adisi elektrofilik pada bab ini:
Metil. Pertanyaan selanjutnya adalah bagaimana karbokation mempengaruhi laju reaksi dan menentukan pembentukan produk akhir? Meskipun karbokation ditentukan oleh ∆G0, laju reaksi ditentukan oleh ∆G‡. Kedua nilai ini tidak berhubungan langsung. Secara umum, karbokation yang lebih stabil menghasilkan produk akhir lebih cepat dibandingkan karbokation yang kurang stabil. Hammond pertama kali menjelaskan hubungan antara stabilitas karbokation dan laju reaksi pada tahun 1955. Selanjutnya penjelasan ini disebut postulat Hammond. Postulat ini menjelaskan hubungan antara stabilitas karbokation dan laju reaksi dengan memeriksa tingkat energi dan struktur keadaan transisi.
Kimia Organik I 111 Lebih banyak reaksi antara Lebih banyak reaksi antara Lebih lambat Kurang stabil Lebih lambat Kurang stabil energik Produk antara Energi stabil Jarak reaksi lebih stabil Lebih banyak reaksi Laju reaksi lebih cepat Laju reaksi (a) (b) 4.34. angka. Keadaan transisi Keadaan transisi mewakili energi maksimum. Mereka memiliki energi aktivasi yang tinggi dan membentuk spesies yang stabil. Karena bentuk keadaan transisi tidak dapat diisolasi karena mempunyai umur terpendek, maka bentuk keadaan transisi dapat digambarkan dengan menggambarkan bentuk yang paling mendekati struktur paling stabil. 4.35. fase reaksi endergonik (a) dan fase reaksi eksergonik (b) ditunjukkan pada Gambar. Dalam reaksi endergonik, tingkat energi keadaan transisi tidak berbeda secara signifikan dengan tingkat energi produk, dan tingkat energi produk lebih tinggi dibandingkan tingkat energi reaktan. Dengan kata lain, dalam reaksi endergonik, keadaan transisi mempunyai energi yang sama dengan produknya. Sebaliknya, dalam reaksi eksergonik, energi keadaan transisi sama dengan energi reaktan, dan energi produk lebih kecil dari energi reaktan.
112 St. Leli Prasojo, S. Pharm., Op. Keadaan transisi Keadaan transisi produk energi Produk masukan energi Laju reaksi Laju reaksi (a) (b) 4.35. angka. Diagram energi dalam reaksi endergonik dan eksergonik Bagaimana postulat Hammond dapat diterapkan pada reaksi adisi elektrofilik? Pembentukan karbokation melalui protonasi merupakan langkah reaksi endergon. Dengan demikian, struktur keadaan transisi mirip dengan struktur karbokation. Faktor yang mempengaruhi kestabilan zat antara karbokation adalah kestabilan keadaan transisi. Karena kehadiran substituen alkil menstabilkan karbokation, ia berpartisipasi dalam stabilisasi keadaan transisi. Karbokation stabil terbentuk lebih cepat karena kestabilannya tercermin dari keadaan transisi yang membentuknya.
Solution: Contoh Soal Materi Kimia Karbon
HBr C C R R R R ALKEN Keadaan transisi R H C R C R R Karbokation 4.36. angka. Pembentukan hipotetis keadaan transisi dalam reaksi protonasi alkena Ketika memprotonasi alkena, keadaan transisinya mirip dengan karbokation, kita dapat berasumsi bahwa atom karbon dalam alkena berhibridisasi ulang dari sp2 ke sp3, membentuk atom karbon bermuatan positif. Keadaan transisi ini distabilkan oleh efek hiperkonjugasi dan induksi yang mirip dengan stabilisasi karbokation. Semakin banyak gugus alkil yang terikat maka keadaan transisi semakin stabil dan semakin cepat pula keadaan transisi terbentuk.
HCl H3C CC CC H3C C C H3C CH H Cl HH H 3-metil-1-butena 2-kloro-3-metilbutana 2-kloro-2-metilbutana 50% 50% 4.37. angka. Bagaimana reaksi antara 3-metil-1-butana dan asam klorida dapat dijelaskan, selama pembentukan 2-kloro-2-metilbutana? Jika reaksi berlangsung dalam satu tahap maka sulit untuk menentukan apa yang dimaksud dengan penataan ulang, namun jika terdapat beberapa tahap reaksi maka penataan ulang tersebut dapat dijelaskan. Whitmore menjelaskan bahwa karbokation adalah zat antara yang tersusun ulang. Struktur karbokation sekunder yang terbentuk dari protonasi 3-metil-1-butena berubah, sehingga menjadi karbokation tersier yang lebih stabil akibat perpindahan hidrida. Pergeseran hidrida adalah perpindahan hidrogen dan pasangan elektronnya (H:) dari satu atom karbon ke atom karbon yang berdekatan dalam molekul.
H Cl H3C CH H 3-Metil-1-butena CH3 H H3C H H3C C C H C H H H3C C H3C C H H H3C Karbokation 20 Karbokation 30 Cl Cl CH3 H H3C Cl H H3C CC H CC H H3C C HCl- H3C H3C, -2,3 -dimetilbutana 4.38. angka. Reaksi 3,3-dimetil-1-butena dengan asam klorida. Pada dasarnya tujuan penataan ulang karbokation adalah untuk menciptakan karbokation yang lebih stabil.

116 St
Reaksi Adisi Nukleofilik Pada Piridin
Apa itu bahan kimia, apa itu kebiri kimia, apa itu kimia, jelaskan apa yang dipelajari dalam ilmu kimia, reaksi kimia adisi, apa itu kimia organik, apa itu jurusan teknik kimia, apa itu perubahan kimia, apa itu kimia industri, apa saja yang di pelajari dalam ilmu kimia, apa itu reaksi kimia