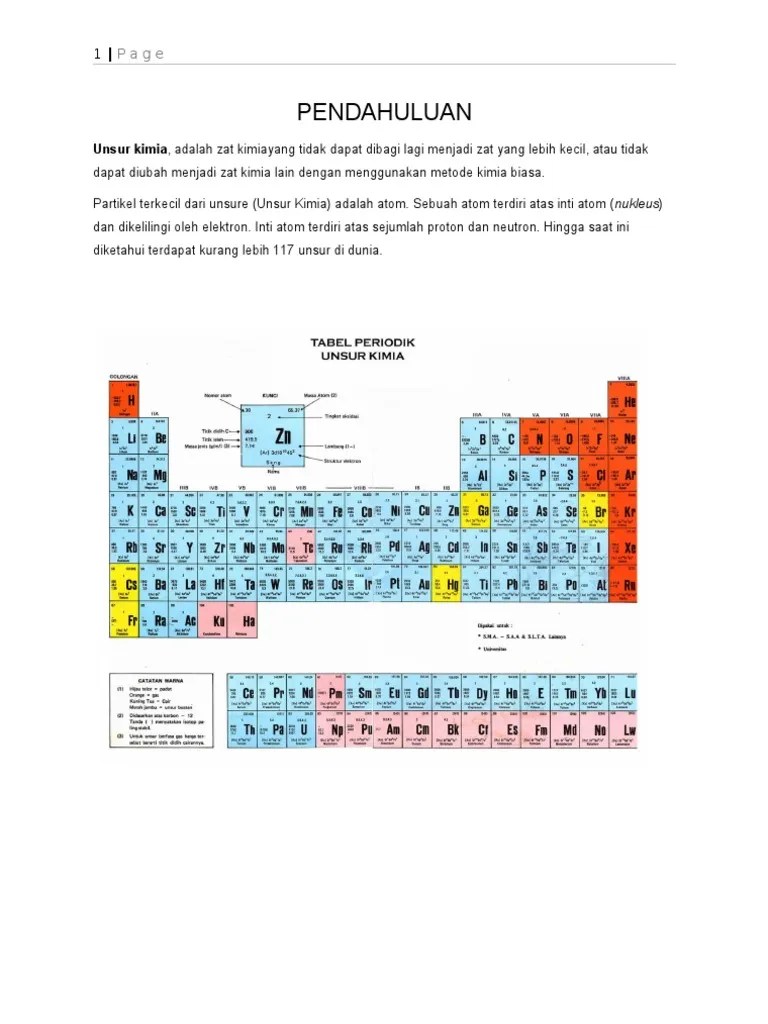
Gambar Sistem Periodik Unsur Kimia – Tabel periodik unsur kimia merupakan tabel yang menunjukkan masing-masing unsur kimia dalam setiap sistem. Ada 118 unsur dalam tabel periodik unsur kimia.
, tabel periodik adalah tabel susunan unsur-unsur kimia berdasarkan nomor atomnya. Dalam tabel periodik unsur-unsur disusun dari nomor atom terendah hingga tertinggi, dari nomor atom hidrogen hingga organozon.
Gambar Sistem Periodik Unsur Kimia

, tabel periodik unsur kimia telah ada dan digunakan sejak ditemukan oleh Dmitri Mendeleev. Dia adalah seorang ahli kimia di Kekaisaran Rusia yang menciptakan tabel periodik berdasarkan peningkatan nomor atom.
Tabel Praktis Sistem Periodik Unsur Kimia
Angka ini menunjukkan jumlah proton yang terdapat dalam inti atom. Jumlah proton sama dengan jumlah elektron yang mengelilingi atom bebas.
Mendeleev menemukan tabel periodik ini ketika menyiapkan buku teks untuk murid-muridnya. Ketika ia menyusun unsur-unsur berdasarkan kenaikan massa atom, ia menemukan bahwa unsur-unsur dengan sifat serupa muncul dalam interval yang berbeda.
Singkatnya, pada awal tahun 1869 ia mampu mempresentasikan hasil karyanya kepada Masyarakat Kimia Rusia. Pengelompokan unsur-unsur dalam tabel periodik modern merupakan penyempurnaan dari hukum periodik Mendeleev yang dikenal dengan tabel periodik diperpanjang.
Dalam hal ini, konstruksi tabel periodik modern didasarkan pada pertumbuhan atom dan kesamaan sifat-sifatnya. Tabel periodik modern terdiri dari 7 periode, dan periode-periode tersebut terbagi menjadi dua jenis, yaitu periode panjang (4, 5, 6 dan 7) dan periode pendek (1, 2 dan 3).
Kimia Kelas 10: Sistem Periodik Unsur
Jumlah golongan pada tabel periodik terdiri dari delapan golongan utama (golongan A) dan delapan golongan tambahan (golongan B). Unsur-unsur golongan B disebut unsur transisi. Letak unsur golongan B berada di antara golongan IIA dan IIIA.
Cara membaca tabel periodik unsur kimia adalah dari kiri atas ke kanan bawah, memahami golongan unsur, memahami periode unsur, dan membedakan logam, semilogam, dan nonlogam.
Cara membaca tabel periodik unsur kimia didasarkan pada urutan nomor atomnya. Unsur-unsur diurutkan dari nomor atom terkecil ke kiri atas.

Dengan bertambahnya nomor atom, unsur-unsur disusun dalam kolom dari atas ke bawah, berakhir di pojok kanan bawah.
Jual Tabel Kimia Sistem Periodik Original Harga Termurah Mei 2024
Tabel periodik unsur kimia memiliki nomor berdasarkan sifat unsur berdasarkan jari-jari atom, keelektronegatifan, energi ionisasi, logam dan nonlogam, dan afinitas elektron. Tabel periodik adalah tabel yang menunjukkan masing-masing unsur kimia dalam setiap sistem. Ada banyak sekali unsur kimia yang mempunyai sifat berbeda antara satu unsur dengan unsur lainnya.
Kutipan kelas
Jika dikelompokkan dalam tabel periodik, sifat fisik dan kimia setiap unsur dicantumkan oleh ahli kimia dalam bentuk tabel unsur.
Fungsi tabel periodik unsur adalah membantu menemukan nomor atom, konfigurasi elektron, dan mempelajari sifat-sifat setiap unsur serta keteraturannya.
Sifat Periodik Unsur Kimia: Jari Jari Atom & Energi Ionisasi
Dalam tabel periodik, Anda akan menemukan golongan dan periode dalam satu kolom. Golongan adalah kolom vertikal atau baris vertikal tabel periodik. Sedangkan titik adalah garis atau baris mendatar.
Pengelompokan unsur-unsur berdasarkan sifat serupa telah berkembang dari yang paling sederhana hingga yang paling canggih. Dimulai dari Antoine Lavoisier hingga disempurnakan oleh ahli kimia Inggris Henry Moseley yang menemukan cara menentukan nomor atom.
Dalam buku Kimia Nan Sutra dijelaskan bahwa pada tahun 1913 Moseley melakukan eksperimen pengukuran panjang gelombang unsur dengan menggunakan sinar-X.

Penelitian Moseley menyimpulkan bahwa sifat dasar tidak didasarkan pada massa atom relatif, tetapi pada pertambahan jumlah proton, akibat adanya unsur-unsur dengan massa atom berbeda yang disebut isotop, tetapi jumlah protonnya sama.
Sistem Periodik Unsur
Peningkatan jumlah proton ini mencerminkan peningkatan nomor atom suatu unsur. Jadi, sifat-sifat unsur merupakan fungsi periodik dari nomor atomnya.
Tabel periodik modern sendiri terdiri dari 7 periode. Periode dibedakan menjadi 2 jenis yaitu periode panjang (4, 5, 6 dan 7) dan periode pendek (1, 2 dan 3).
Jumlah golongan pada tabel periodik terdiri dari 8 golongan utama (golongan A) dan 8 golongan tambahan (golongan B). Unsur-unsur golongan B disebut unsur transisi. Letak unsur golongan B berada di antara golongan IIA dan IIIA.
Dalam tabel periodik, Anda dapat menemukan bilangan berdasarkan sifat unsur berdasarkan jari-jari atom, keelektronegatifan, energi ionisasi, logam dan nonlogam, serta afinitas elektron.
Lkpd Sistem Periodik Unsur Activity
Jari-jari atom adalah jarak inti atom sampai kulit terluar atom. Terkadang, jari-jari atom cenderung bertambah dari atas ke bawah dalam satu golongan. Hal ini disebabkan bertambahnya nomor atom dan kulit elektron suatu golongan.
Dalam satu periode, dari kiri ke kanan, jari-jari atom cenderung mengecil, begitu pula muatan inti efektifnya. Semakin besar jumlah proton dalam muatan inti efektif, semakin besar gaya tarik inti terhadap elektron terluar.
Ionisasi adalah energi untuk melepaskan elektron lemah yang terkait dengan atom atau ion dalam bentuk gas. Secara periodik dalam satu golongan, dari atas ke bawah energi ionisasinya berkurang dalam satu periode, dari kiri ke kanan energi ionisasinya bertambah.

Secara berkala, pada golongan atas ke bawah, afinitas elektron cenderung menurun (menurun) dari kiri ke kanan sampai golongan VII A dan cenderung meningkat (meningkat) kecuali unsur alkali tanah dan gas mulia.
Solution: Sistem Periodik Unsur
Semua unsur golongan utama mempunyai afinitas elektron negatif, dengan unsur golongan terbesar termasuk dalam golongan halogen. Semakin negatif nilai afinitas elektron maka semakin besar pula kecenderungan atom atau ion untuk menerima elektron (afinitas elektron semakin tinggi).
Keelektronegatifan atau keelektronegatifan adalah kecenderungan suatu atom untuk menarik pasangan elektron sehingga membentuk ikatan. Unsur-unsur dengan energi ionisasi dan afinitas elektron yang tinggi mempunyai keelektronegatifan yang tinggi.
Secara periodik dalam suatu golongan, dari atas ke bawah, keelektronegatifan berkurang, dan dari kiri ke kanan dalam periode tertentu cenderung meningkat sehingga memudahkan tarik-menarik atom. Nilai keelektronegatifan dapat diukur antara 0,7 (Fr) – 4,0 (Fr) dengan menggunakan skala Pauling.
Kecenderungan atom kehilangan elektron dan membentuk ion bermuatan positif (tergantung energi ionisasinya) merupakan sifat logam dan logam.
Sistem Periodik Unsur, Kenali Penomoran Dan Sifat Sifatnya
Sifat logam berkaitan dengan sifat listrik. Semakin tinggi energi ionisasi maka semakin rendah sifat logamnya, karena semakin sulit melepaskan elektronnya. Sedangkan sifat nonlogam berkaitan dengan keelektronegatifan, atau kecenderungan atom dalam menyerap elektron.
Nonlogam yang paling reaktif adalah golongan VIIA (lihat Sifat Logam dan Nonlogam), sedangkan Golongan VIIIA (gas mulia) tidak reaktif.
Secara periodik dari atas ke bawah dalam satu golongan semakin kecil, dan dalam satu periode dari kiri ke kanan mula-mula mengecil dan bertambah pada golongan VIIA., Jakarta Tabel Periodik Unsur adalah tabel yang menunjukkan unsur-unsur kimia. Unsur-unsur kimia tersebut disusun berdasarkan nomor atom (jumlah proton dalam inti atom), konfigurasi periodik, dan keterulangan sifat-sifat kimianya.

Tabel periodik berfungsi untuk mengetahui nomor atom, konfigurasi elektron, dan sifat setiap unsur. Tabel periodik unsur kimia terdiri dari dua golongan unsur, golongan pertama (kolom vertikal) dan golongan periode kedua (kolom horizontal).
Struktur Atom Dan Sistem Periodik Unsur
Tabel periodik unsur harus dipahami ketika mempelajari kimia. Ada dua cara memberi nama unsur kimia dalam tabel periodik, yaitu cara tradisional dan cara IUPAC (International Union of Pure and Applied Chemistry).
Seperti yang telah disebutkan, tabel periodik unsur kimia terdiri dari dua golongan, yaitu golongan dan periode. Berikut golongan dari tabel periodik unsur:
Golongan disusun dalam kolom vertikal pada tabel periodik unsur modern. Mendefinisikan grup berkaitan dengan properti elemen. Unsur-unsur suatu golongan mempunyai sifat yang serupa.
Periode tercantum dalam kolom horizontal tabel periodik unsur kimia. Periode suatu unsur menunjukkan jumlah kulit yang terisi elektron (n terbesar) berdasarkan konfigurasi elektronnya. Terdapat 7 periode dalam sistem periodik unsur, yaitu:
Bagaimana Dmitri Mendeleev Menciptakan Tabel Periodik Unsur Kimia?
Sifat-sifat elemen. Berdasarkan sifat unsurnya dibedakan menjadi 3 golongan yaitu logam, nonlogam, dan logam. Logam mempunyai sifat yang cenderung melepaskan elektron dari nonlogam sehingga membentuk ion positif. Adapun nonlogam cenderung menerima elektron dari logam. Hal ini berbeda dengan unsur metaloid yang mempunyai sifat logam dan nonlogam.
Sinar atom. Jari-jari atom adalah jarak dari inti atom ke orbit elektron paling stabil dari suatu atom dalam keadaan setimbang. Jarak ini dapat diukur dalam pikometer atau angstrom. Dari golongan atas, jari-jari atom cenderung bertambah seiring bertambahnya jumlah kulit elektron.
Reaktivitas. Dalam tabel periodik unsur, reaktivitas suatu unsur bertambah dari kiri ke kanan dalam satu periode sampai golongan VIIA.

Energi ionisasi. Energi ionisasi yang pertama adalah energi yang diserap untuk melepaskan elektron dari suatu atom. Sedangkan energi ionisasi atom lain adalah energi yang diserap untuk melepaskan elektron lain dari atom tersebut.
Pengertian Tabel Periodik, Struktur, Jenis Serta Cara Menghafal & Menentukan Unsur
Ikatan elektron. Afinitas elektron adalah jumlah energi yang dilepaskan ketika elektron ditambahkan ke kolom atom netral untuk membentuk ion negatif. Sifat nonlogam mempunyai nilai afinitas elektron yang lebih tinggi dibandingkan sifat logam. Dan afinitas elektron rata-rata meningkat seiring waktu.
*Kebenaran atau penipuan? Untuk mengetahui keaslian informasi yang beredar, silahkan cek nomor WhatsApp asli 0811 9787 670 dengan mengetikkan kata kunci yang diinginkan., Bagi yang ingin belajar kimia Jakarta wajib mengetahui tabel periodik unsur. Dalam istilah kimia, sistem ini disebut tabel periodik. Tugasnya adalah menemukan nomor atom, konfigurasi elektronik, dan sifat setiap unsur.
Tabel periodik unsur merupakan susunan unsur berdasarkan nomor atom dan kesamaan sifat antar unsur. Mengetahui, memahami dan mengingat reaksi kimia sangat penting untuk dapat menghitungnya.
Mungkin terdengar rumit, namun jika Anda sering melakukannya, Anda akan lebih mudah mengingatnya. Tabel periodik ini dibagi menjadi tujuh kelompok.
Sistem Periodik Unsur
Tabel periodik yang disusun oleh Moseley berkembang lebih jauh hingga akhirnya mengambil bentuknya yang sekarang mengikuti hukum periodik:
Tabel periodik
Sistem periodik unsur kimia lengkap, materi kimia sistem periodik unsur, unsur periodik kimia lengkap, sistem periodik unsur kimia pdf, gambar unsur periodik kimia, tabel sistem periodik unsur kimia, kimia sistem periodik unsur, periodik unsur-unsur kimia, perkembangan sistem periodik unsur kimia, gambar tabel periodik unsur kimia, daftar periodik unsur kimia, tabel unsur periodik kimia